恩西地平(Idhifa)的批准用于什么?
发布日期:2024-02-24 浏览次数:次
美国食品药品监督管理局(FDA)今天批准Idhifa(enasidenib)用于治疗具有特定基因突变的复发或难治性急性髓系白血病(AML)成人患者。该药物被批准用于伴随诊断,即实时 IDH2 检测,用于检测 AML 患者 IDH2 基因的特定突变。
关于恩西地平DHIFA 是第一个也是唯一一个口服的 IDH2 靶向抑制剂,FDA 对 IDHIFA 的批准是基于 I/II 期 AG-221 AML-001 研究的结果,包括安全性、完全缓解 (CR) 或 CR 与部分血液学恢复 (CRh) 的比率和持续时间以及转化为输血独立性。复发和难治性 AML 是一种使人衰弱的疾病,具有重大未满足的医疗需求。
关于急性髓系白血病(AML)
AML是一种血液和骨髓癌症,其特征是疾病进展迅速,是影响成人的最常见的急性白血病,估计美国每年有超过21,000例新病例.4,5,6大多数AML患者最终会复发。复发或难治性AML的预后较差。对于8%至19%的AML患者,突变的IDH2酶会阻断正常的血细胞发育,并导致未成熟血细胞过多。

证明IDHIFA1的临床益处和安全性
FDA的批准是基于一项针对患有 R/R AML 和 IDH2 突变的成年患者的开放标签、单臂、多中心、双队列临床试验的临床数据(研究 AG221-C-001,NCT01915498)。IDHIFA 与 Abbott RealTime™ IDH2 伴随诊断测试同时获得批准,后者已获得 FDA 批准,可帮助识别 AML 患者接受 IDHIFA 治疗。
在 199 例患有 R/R AML 和 IDH2 突变的成年患者中评估了 IDHIFA 的疗效。IDH2 突变通过 Abbott RealTime™ IDH2 测试鉴定或确认。IDHIFA 以每天 100 mg 的起始剂量口服给药,直到疾病进展或出现不可接受的毒性。允许减少剂量以控制副作用。患者的中位年龄为 68 岁(范围为 19 至 100 岁),并且接受过两种既往抗癌方案(范围为 1 至 6 种)的中位数。超过一半(52%)的患者对既往治疗无效。
在这项试验中,IDHIFA 显示出完全缓解或完全缓解,部分血液学改善 (CR/CRh) 率为 23% (n=46)(95% CI:18%,30%)。CR/CRh的中位持续时间为8.2个月(95%CI:范围4.3,19.4)。对于达到 CR/CRh 的患者,首次缓解的中位时间为 1.9 个月(范围为 0.5 至 7.5 个月),CR/CRh 达到最佳缓解的中位时间为 3.7 个月(范围为 0.6 至 11.2 个月)。在达到 CR/CRh 的患者中,85%(46 名患者中有 39 名)在开始 IDHIFA 后 6 个月内达到 CR/CRh。
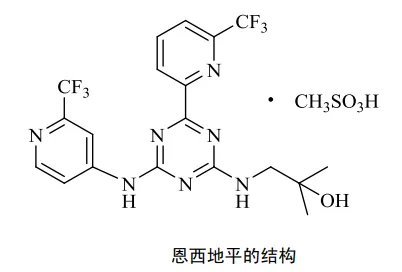
在基线时依赖红细胞 (RBC) 和/或血小板输注的 157 例患者中,53 例 (34%) 在基线后 56 天内独立于红细胞和血小板输注。在基线时同时不输红细胞和血小板的 42 例患者中,32 例 (76%) 在基线后 56 天内保持输血独立。
在 214 例 R/R AML 和 IDH2 突变患者中评估了 IDHIFA 的安全性。暴露于IDHIFA的中位持续时间为4.3个月(范围为0.3至23.6)。IDHIFA 观察到的 30 天和 60 天死亡率分别为 4.2% (9/214) 和 11.7% (25/214)。
在临床试验中,14%接受IDHIFA治疗的患者经历了分化综合征,如果不治疗,这可能是致命的。如果给孕妇服用 IDHIFA 会对胎儿造成伤害。任何级别最常见的不良反应(≥20%)是恶心、呕吐、腹泻、胆红素升高和食欲下降。77.1%的患者报告有严重不良反应。最常见的严重不良反应(≥2%)为白细胞增多、腹泻、恶心、呕吐、食欲下降、肿瘤溶解综合征和分化综合征。
印度肿瘤药房(India Pharmacy)是印度新德里肿瘤药房信息咨询服务平台,旨在为患者提供各类进口原研 进口仿制 最新研制等医药信息咨询 跨境医药电商直邮服务,让患者轻松获取全球最佳药品有更多选择,基本涵盖新特药 抗癌药 靶向药 丙肝 乙肝 高血压 糖尿病 痛风 等药品,欢迎咨询!官方微信 Yindu7689
